Por Siddhartha Giese | analista químico da Assessoria Técnica do CFQ
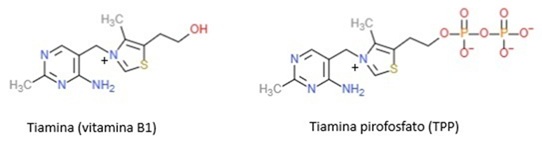
A tiamina, em sua forma ativa — o pirofosfato de tiamina (TPP ou cocarboxilase) — atua como coenzima em diversas reações bioquímicas. Entre elas, destacam-se a descarboxilação do piruvato em processos fermentativos alcoólicos (formando acetaldeído), e, nos organismos superiores, a descarboxilação oxidativa do piruvato para formar acetil-CoA, componente-chave do ciclo de Krebs. O TPP é também uma coenzima de enzimas fundamentais como a transcetolase na via das pentoses, a piruvato desidrogenase e a ?-cetoglutarato desidrogenase nas mitocôndrias, todas envolvidas em etapas críticas do metabolismo energético e da produção de ATP. A fórmula estrutural da tiamina e do pirofosfato de tiamina (TPP) estão representados na Figura 1.
Figura 1. Representação das estruturas químicas da tiamina e do pirofosfato de tiamina (TPP). Os contraíons não foram representados.
Diversas hipóteses foram propostas para explicar o papel da tiamina na facilitação dessas reações. Uma das primeiras, formulada por Langenbeck, sugeria que o grupamento amina da tiamina reagia com o ácido pirúvico por meio de condensação, formando uma base de Schiff. Essa base, então, sofreria descarboxilação, gerando acetaldeído, após ser hidrolisado, regenerando a tiamina. Essa proposta, no entanto, não atribuía qualquer função ao anel tiazolínico da tiamina. Cabe lembrar ao leitor, que uma base de Schiff (azometina), é um composto orgânico caracterizado pela presença do grupo funcional imina (R2–C=N–R’), resultante da condensação entre uma amina primária e um aldeído ou cetona, obtido por uma adição nucleofílica da amina ao carbono da carbonila.
Proposta formulada por Langenbeck baseada no artigo de Breslow, 1958.
Posteriormente, Stern e Melnick demonstraram que a tiamina, ao contrário de outras aminas primárias, não promovia efetivamente a descarboxilação via base de Schiff, lançando dúvidas sobre a proposta de Langenbeck. A baixa reatividade observada, foi atribuída, na época, à ressonância do grupo amina com o anel ao qual está ligado, o que reduziria sua nucleofilicidade.
Mais tarde, Valenta e Wiesner retomaram a ideia da formação da base de Schiff, mas propuseram que essa espécie poderia sofrer tautomerização para a formação de um ileto. Um ileto é uma molécula neutra com um átomo de carga positiva (geralmente fósforo, enxofre ou nitrogênio) diretamente ligado a um átomo adjacente de carga negativa (normalmente um carbono). Nesse modelo, o anel tiazolínico da tiamina contribuiria para a estabilização do ileto gerado.
Contudo, a época, todas essas hipóteses se mostraram de difícil comprovação experimental, principalmente quanto à atuação da tiamina em sistemas enzimáticos específicos.
Avanços importantes vieram com os trabalhos de Mizuhara, que demonstrou a capacidade da tiamina em descarboxilar o ácido pirúvico em meio aquoso (pH 8,4) e à temperatura ambiente, sem auxílio enzimático. Nessas condições, a tiamina foi capaz de catalisar a formação de acetoína (3-hidroxibutan-2-ona) a partir de ácido pirúvico e acetaldeído com liberando CO2, via condensação aldólica.
Nesse contexto, o TPP forma um carbanion que ataca o piruvato, promovendo sua descarboxilação e liberação de CO?, gerando a espécie CH?–CH(OH)–TPP. Em seguida, o grupo hidroxietil resultante, ataca a carbonila do acetaldeído, formando uma nova ligação C–C. Após a protonação e liberação da TPP, obtém-se a acetoína. Cabe ressaltar, esse pesquisador, testou a atividade catalítica de um possível intermediário dissulfeto de tiamina oriundo da abertura do anel tiazolínico, porém nenhuma atividade foi observada.
Embora o modelo de Mizuhara reproduza adequadamente reações da tiamina em sistemas biológicos, o pH utilizado (8,4) é mais básico do que o normalmente encontrado em ambientes intracelulares. Isso sugere que o microambiente enzimático pode apresentar regiões localmente mais básicas, para ser compatível com o mecanismo proposto.
Em continuidade a esses estudos, Breslow testou diversos compostos como catalisadores, demonstrando que a presença do ácido pirúvico não era necessária, pois a tiamina foi capaz de catalisar a autocondensação do acetaldeído em acetoína, tal como ocorre nos sistemas biológicos. No entanto, o rendimento de acetoína é um pouco maior quando se utiliza a mistura de ácido pirúvico com o acetaldeído.
Para elucidar o mecanismo de catálise, Breslow realizou a condensação do furfural para produzir a furoína, utilizando brometo de N-benzil-(? d2)?tiazólio deuterado no carbono metilênico como catalisador. A ausência de troca isotópica durante a reação confirmou que o a catálise não envolve o grupo metileno ligado ao nitrogênio.
A partir disso, Breslow propôs que tiazólios (como a tiamina) podem sofrer ionização no carbono-2 (C-2), formando um ileto altamente estabilizado. O intermediário C-2-aniônico atuaria como nucleófilo que pode se adicionar à aldeídos. O ânion em C-2 seria estabilizado por efeitos indutivos do nitrogênio positivo vizinho e uma possível ressonância.
A atividade catalítica desaparece quando o C-2 está bloqueado, reforçando a importância do ileto no mecanismo. Breslow demonstrou também que a instabilidade do intermediário da reação impede seu isolamento, mas sua existência foi inferida a partir dos produtos da decomposição rápida de derivados sintéticos, como evidenciados na decomposição do 2-(?-hidroxibenzil)-4-metiltiazol tratado com o iodeto de metila.
Atualmente, sabe-se que a TPP atua estabilizando intermediários carbanions importantes durante reações enzimáticas. A região da molécula de TTP mais relevante para a catálise é o anel de tiazol. Nesse anel, o átomo de carbono (C-2) situado entre o nitrogênio e o enxofre possui um hidrogênio fracamente ácido, com pKa em torno de 18.
Essa acidez pode ser explicada por dois fatores principais: 1) O átomo de enxofre, com seus orbitais d vazios, pode acomodar parte da carga negativa do ânion conjugado; 2) A carga positiva no nitrogênio vizinho ajuda a estabilizar essa carga negativa. Quando esse próton é removido, forma-se um ileto. O carbono negativamente carregado do ileto é altamente nucleofílico, sendo capaz de atacar centros positivos, como carbonos carbonílicos de ?-cetoácidos e cetoaçúcares. Em reações dependentes de TPP, o primeiro passo é justamente o ataque nucleofílico desse carbono a um grupo carbonila do substrato.
A pesquisa de Solovjeva demonstrou que a enzima transcetolase, que utiliza a tiamina pirofosfato (TPP) como coenzima, ativa o TPP por meio da eliminação de uma molécula de água ligada covalentemente ao carbono 2 (C-2) do anel tiazol. Essa eliminação leva à geração de um íon carbanion (ileto), espécie altamente reativa e fundamental para o início do ciclo catalítico. A presença da molécula de água no sítio ativo enzimático é, portanto, um componente-chave da ativação catalítica da TPP.
A hipótese de Breslow de que um carbeno — espécie altamente reativa — pudesse ser estável em meio aquoso foi, por décadas, considerada visionária. Raviprolu e colaboradores, em um estudo publicado na Science Advances (2025), relataram a primeira evidência espectroscópica direta de um N-heterocíclico carbeno (NHC) estável em água.
Embora as espécies isoladas por sua equipe não repliquem exatamente o intermediário proposto por Breslow, elas atuariam de forma análoga, criando um ambiente químico protegido, que favorece termodinamicamente a formação do carbeno e o estabiliza cineticamente. Assim, os autores confirmam a hipótese de Breslow: “é possível, sob condições adequadas, obter carbenos persistentes em solução aquosa”.
A descoberta de carbenos persistentes ganhou novo impulso com os trabalhos de Bertrand e Arduengo, que relataram os primeiros carbenos N-heterocíclicos (NHC) que podiam ser isolados e armazenados, como o fosfinossililcarbeno e o N,N-diadamantilimidasolilideno, respectivamente. Apesar disso, esses compostos ainda não eram estáveis ao ar, devido à sua suscetibilidade à hidrólise. Para contornar essa limitação, Arduengo introduziu substituintes volumosos (N-mesitila) e realizou cloração do esqueleto imidazolilideno, promovendo um efeito indutivo ? que estabilizava o carbânion. Contudo, a estabilidade desses carbenos em meio aquoso permanecia não comprovada.
O grupo de Raviprolu citou o preparo de um sal de imidazólio aniônico e seu correspondente dianiônico, ambos ligados a ânions carboranos do tipo closo (CB9¹?).
No mesmo estudo, os pesquisadores sintetizaram uma versão policlorada do carboranil NHC, o 12-vertex N-carboranil (CB11¹?), a partir dos compostos anteriores, com altos rendimentos. A geração do carbeno foi realizada por meio da reação com bis(trimetilsilil)amida de lítio na proporção de 1:2.
Segundo os autores, as análises por RMN de ¹H do carbeno clorado comprovaram a ausência do sinal do hidrogênio imidazólico, e a RMN de ¹¹B indicou, segundo o autor, a retenção da simetria C??, evidenciando a formação de um único produto com rendimento quantitativo. Já a RMN de ¹³C revelou um sinal em 239 ppm, atribuído ao carbono do carbeno. O deslocamento do sinal para campo mais baixo em relação ao composto não clorado (200 ppm) confirma o efeito desblindante promovido pelos grupos cloretos, de caráter retirador de elétrons.
A estrutura clorada foi, ainda, caracterizada por difratometria de raios X de monocristal, que revelou um carbeno dianiônico no estado sólido. A estrutura também mostrou uma distância superior a 10 Å entre o carbeno e o cátion lítio, sugerindo a existência de um carbeno livre. A partir desses dados, foi possível construir o modelo de ocupação espacial (space-filling model) da estrutura, demonstrando que a estabilidade é atribuída à proteção estérica promovida pelos grupos cloretos do carborano, que blindam tanto o par de elétrons ? quanto os orbitais ? do carbono. A cloração do esqueleto imidazólico estabiliza eletronicamente o orbital não ligante do carbeno, tornando-o menos nucleofílico e, consequentemente, menos reativo à água. Notavelmente, esse carbeno permaneceu quimicamente estável por pelo menos seis meses em solução aquosa, mesmo sob excesso de água pura.
Com isso, os autores fornecem evidência inequívoca de que carbenos persistentes podem existir em meio aquoso, validando a proposta de Ronald Breslow feita em 1958.
Referências:
Fonte: https://cfq.org.br/noticia/vitamina-b1-tiamina/

Conselho Regional de Química 2ª Região
Minas Gerais
Av. Nossa Senhora do Carmo, 651 - Carmo, Belo Horizonte - MG - 30330-000
(31) 3279-9800 / (31) 3279-9801